NB: Onderstaande tekst is geschreven in het voorjaar van 2019. Dit was voordat Roche de prijs van hun RT-CGM verlaagde voor particulieren, en voordat FGM vergoed werd voor iedereen op intensieve insulinetherapie.
Kosten van het (niet) vergoeden van de glucosesensor
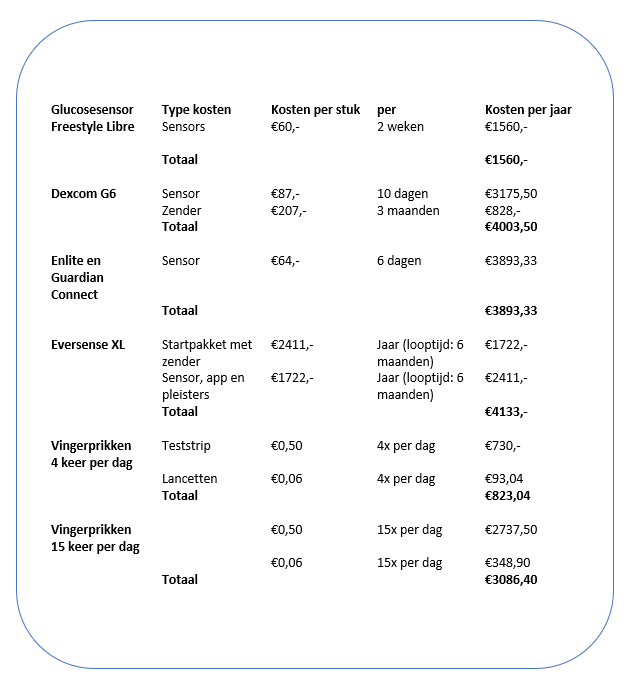
Er wordt veel gesproken over de hoge kosten van een glucosesensor. Dit is logisch, want wanneer een hulpmiddel niet vergoed wordt, gaan patiënten toch proberen dit zelf aan te schaffen. Bedragen tussen de €1560,- en €4000,- zijn voor de gemiddelde Nederlander hoog, zeker wanneer het elk jaar weer opnieuw uitgegeven moet worden. Wanneer de glucosesensor echter gewoon vergoed wordt, liggen de zaken anders. De kosten en besparingen komen dan immers uit hetzelfde budget.
De kosten van de glucosesensor lopen uiteen van €1.560,- tot zo’n €4.000,- per jaar. De ouderwetse manier van glucosemetingen doen (de vingerprik) kost tussen de €800,- en €3.000,- per jaar. Een overzicht van de kosten per meetmethode vindt u onderaan deze pagina. De kosten tussen vingerprikken en de glucosesensor liggen vrij dicht bij elkaar, en in het geval waar iemand acht keer per dag (of vaker) in de vingers prikt voor een bloedsuikermeting, is de Freestyle Libre à €1560,- per jaar zelfs per direct al een goedkopere optie.
Mensen die een glucosesensor gebruiken, kunnen er voor kiezen om minder vaak op controle te komen bij hun arts, diëtist of diabetesverpleegkundige. De glucosesensor geeft deze mensen meer regie over hun eigen leven, waardoor minder overleg met specialisten nodig is. Bovendien kan een deel van de afspraken in de polikliniek van het ziekenhuis vervangen worden door een telefonische afspraak of overleg via e-mail. De behandelaar kan immers toegang krijgen tot door de sensor gemeten bloedglucosewaardes, en zo op afstand passend advies geven. Een poliklinische afspraak van een patiënt met een internist kost ruim €90,- per keer, en een afspraak met een diëtist € 27,-. Beiden kunnen veel minder vaak plaatsvinden.
Op basis van wat we hebben gezien in België en Duitsland, waar de sensor al enige tijd vergoed wordt, kunnen we aannemen dat ook in Nederland zo’n 67% van de 120.000 mensen met diabetes type 1 in overleg met hun behandelaar kiezen voor het gebruik van een glucosesensor. De helft van de mensen met diabetes type 1 gebruikt in die landen de Freestyle Libre, de rest gebruikt een RT-CGM. Als we er van uitgaan dat deze verhouding in Nederland stand houdt, zal het meten met een glucosesensor zo’n €175.200.000,- per jaar kosten. Deze groep meet nu met vingerprikken voor een geschatte €152.760.000,- per jaar. De overgang naar de glucosesensor vraagt dus om een investering van een geschatte 23 miljoen euro per jaar. (NB: bij deze berekening is geen rekening gehouden met de huidige glucosesensor-gebruikers die deze al vergoed krijgen, omdat deze gegevens voor ons niet inzichtelijk zijn. Het werkelijke verschil in kosten zal dus zelfs lager uitvallen.) Deze investering valt in het niet vergeleken met de kostenbesparing die dit zal opleveren. Dit wordt hieronder geschetst.
Eén van de acute problemen die kan voorkomen bij diabetes type 1 (of elk type diabetes dat met insuline behandeld moet worden) is een hypoglycemie. Een hypo is een te lage bloedglucose, met een waarde onder de 4 mmol/l. Glucose is een belangrijke bron van energie voor het lichaam, en wanneer dit niet toereikend beschikbaar is, kunnen het brein, spieren en organen niet meer naar behoren functioneren. Symptomen hiervan zijn trillen, zweten, wazig zien, honger, cognitieve achteruitgang, en wanneer de bloedsuiker nog verder zakt schuimbekken, stuipen en bewusteloosheid. In sommige gevallen is de afloop zelfs dodelijk.
Een hypo wordt gewoonlijk behandeld door het nemen van glucosetabletten, limonade, of andere ‘snelle’ koolhydraten. Wanneer de bloedsuiker echter te snel of te ver daalt, moet er hulp ingeroepen worden. Mensen met diabetes type 1 hebben gemiddeld vijf ernstige hypo’s per jaar. Bij ernstige hypo’s is er hulp van buitenaf nodig. Dit kan een gezinslid of mantelzorger zijn, maar het kan ook noodzakelijk zijn dat er een ambulance komt of dat er een ziekenhuisopname volgt. Er is berekend (Groot et al., 2018) dat een ernstige hypo €828,- per keer kost. Dit bedrag is opgebouwd uit het gebruik van extra teststrips, glucagon en de kosten van hulp- of zorgverleners die dit moeten toedienen, ambulance, ziekenhuisopname, behandeling door ambulancepersoneel bij de patiënt thuis, huisarts, hulp door mantelzorger (à 2 uur per keer), extra afspraken bij specialist of diabetesverpleegkundige, en verloren productiviteit van patiënt en mantelzorger.
Wanneer we enkel kijken naar de kosten van het behandelen van hypoglycemieën in het ziekenhuis, zien we dat deze hoog zijn: jaarlijks 40 miljoen euro (Peters et al, 2017). Uit verschillende onderzoeken blijkt dat het gebruik van een glucosesensor het aantal hypo’s enorm verlaagd. Dit is logisch: mensen worden in het geval van RT-CGM gewaarschuwd voor een lage waarde, en zelfs in het geval van FGM kan de bloedsuiker beter in de gaten gehouden worden. Bovendien vindt ruim de helft van de hypo’s plaats in een kwart van de tijd: tussen 0:00 en 6:00 uur. In de nacht is het alleen met glucosesensor goed mogelijk om de bloedglucose te monitoren. Specifiek wordt door Charleer et al (2018) genoemd dat het aantal ziekenhuisopnames voor hypo’s met 75% is afgenomen als gevolg van vergoeding van de glucosesensor in België. Dit levert in Nederland dus een besparing van dertig miljoen euro per jaar op. Als we dus de investering in glucosesensors afzetten tegen de kosten van ziekenhuisopnames door hypo’s, zijn de kosten voor de vergoeding van de sensor al gedekt.
Zoals prof. dr. Bilo in zijn onderzoek van 2019 en Charleer et. al in 2018 in België aantoonde, neemt ook de arbeidsuitval flink af wanneer mensen met diabetes type 1 een sensor gaan gebruiken. Deze afname bedraagt 53% tot 58%, vergeleken met de arbeidsuitval van dezelfde mensen voordat ze een sensor gebruikten. De geschatte kosten van arbeidsuitval door diabetes type 1 is op jaarbasis €64.834.311,-. Wanneer dit meer dan gehalveerd wordt is de kostenbesparing op dit vlak minstens 34 miljoen euro per jaar.
Hoe groter de schommelingen in bloedglucose, en hoe meer tijd iemand zich in een staat van hyperglycemie (te hoge bloedglucose) bevindt, hoe groter de kans wordt dat die patiënt diabetescomplicaties ontwikkelt (zie o.a. Temelkova-Kurktschiev et al, 2010, en Aanstoot, 2019). Complicaties zijn onder andere hart- en vaatziekten, nierfalen, retinopathie en neuropathie. De kosten voor de behandeling van complicaties zijn hoog. Alleen al de behandeling van nierziekten ten gevolge van diabetes type 1 kost jaarlijks 563 miljoen euro en de behandeling van hartinfarcten ten gevolge van diabetes type 1 128 miljoen euro. Uit enorm veel wetenschappelijk onderzoek (zie het petitiedocument) komt naar voren dat de glucosesensor zorgt voor lagere en stabielere bloedglucosewaardes. Dit betekent dat mensen die een glucosesensor dragen minder complicaties zullen ontwikkelen.
Ook retinopathie, een diabetescomplicatie die behandeld moet worden met injecties in de oogbal en laseroperaties, zal door de sensor minder vaak voorkomen. Uit onderzoek (Beck et al., 2019) blijkt dat elke 10% minder Time in Range (tijd besteed tussen de grenswaarden van een gezonde bloedglucose) een vergroting van de hazard ratio voor de progressie van retinopathie met 64% betekent. Een verschil van 2.5 uur per dag langere Time in Range maakt het verschil tussen het wel of niet ontstaan van micro-bloedvatenschade in de nieren. Betere Time in Range wordt bereikt met de glucosesensor. Uit het onderzoek van (Dunn et al., 2018) blijkt bijvoorbeeld dat Time in Range met bijna 5 uur per dag stijgt bij sensorgebruik. Kortom, de glucosesensor zorgt ervoor dat er minder diabetescomplicaties ontstaan, wat betekent dat er tientallen miljoenen euro’s bespaard kan worden aan de behandeling hiervan.
Bibliografie
Aanstoot, H. (2019, 13 mei). Tijd om wakker te schrikken. Geraadpleegd op 3 juni 2019 van https://diabeter.nl/nl/over-diabeter/nieuws/tijd-om-wakker-te-schrikken/
Accu-chek (2019). Eversense zelf aanschaffen.Geraadpleegd op 30 maart 2019 van https://www.accu-chek.nl/eversense-zelf-aanschaffen
Beck, R.W., Bergenstal, R.M., Riddlesworth T.D., Kollman, C., Li, Z., Brown, A.S., Close K.L. (2019). Validation of Time in Range as an Outcome Measure for Diabetes Clinical Trials, Diabetes Care. Geraadpleegd op 1 maart 2019 https://doi.org/10.2337/dc18-1444.
Bilo, H. (2019, 3 juni). In Zorgprofessionals over de sensor. Geraadpleegd op 20 juni 2019 van https://sensorvergoeding.nl/zorgprofessionals-over-de-sensor/
Bosman (2019) Diabeteszorg. Geraadpleegd op 30 maart 2019 van https://www.mijnbosman.com/Diabetes?filters=sb=TimesOrderedDesc/pg=0/pgsz=12/
Charleer, S., Mathieu, C., Nobels, F., De Block, C., Radermecker, R.P., Hermans, M.P., … Gillard, P. (2018). Effect of Continuous Glucose Monitoring on Glycemic Control, Acute Admissions, and Quality of Life: A Real-World Study. Journal of Clinical Endocrinology & Metabolism, 2018 (3), 1224-1232.
Dunn, T.C., Xu, Y., Hayter, G., Ajjan R.A. (2018). Real-world flash glucose monitoring patterns and associations between self-monitoring frequency and glycaemic measures: A European analysis of over 60 million glucose tests. Diabetes Research and Clinical Practice 137, 37-46.
Freestyle Libre (2019). Het FreeStyle Libre-systeem leren kennen. Geraadpleegd op 30 maart 2019 via https://www.freestylelibre.nl/products.html
Groot, S., Enters-Weijnen, C.F., Geelhoed-Duijvestijn, P.H., Kanters, T.A. (2018). A cost of illness study of hypoglycaemic events in insulin-treated diabetes in the Netherlands. BMJ Open, 8, 1-10.
Khunti, K., Alsifri, S., Aronson, R., Cigrovski Berković, M., Enters-Weijnen, C., Forsén, T., … Ramachandran, A. (2016). Rates and predictors of hypoglycaemia in 27,585 people from 24 countries with insulin-treated type 1 and type 2 diabetes: the global HAT study. Diabetes Obesity and Metabolism, 18, 907-915.
Medtronic (2019). HET MINIMED-SYSTEEM CONTINUE GLUCOSEMONITORING MET DE ENLITE® GLUCOSESENSOR. Geraadpleegd op 30 maart 2019 van https://www.medtronic-diabetes.nl/over-diabetes/continue-glucosemonitoring/enlite-glucose-sensor
Peters, M.L., Huisman, E.L., Schoonen, M., Wolffenbuttel, B.H.R. (2017). The current total economic burden of diabetes mellitus in the Netherlands. The Netherlands Journal of Medicine, 35, (7), 281-297.
Temelkova-Kurktschiev, T.S., Koehler, C., Henkel,E ., Leonhardt, W., Fuecker, K., Hanefeld M. (2000). Postchallenge plasma glucose and glycemic spikes are more strongly associated with atherosclerosis than fasting glucose or HbA1c level. Diabetes Care 23 (12) 1830-1834.
Wolffenbuttel, B. (2019, 29 mei). De sensor moet vergoed ! Geraadpleegd op 3 juni 2019 van https://www.gmed.nl/sensorvergoeding/
Zilveren Kruis (2 juli 2018). Resultaten onderzoek Freestyle Libre veelbelovend. Geraadpleegd op 30 maart 2019, van https://nieuws.zilverenkruis.nl/resultaten-onderzoek-freestyle-libre-veelbelovend/.
Zkope Healthcare (2019). Webshop. Geraadpleegd op 30 maart 2019 via https://www.myglucosemonitor.nl/product-categorie/zkope-healthcare-onze-producten/dexcom-g4-g5-g6/
